CH3COO- + H2O 互逆符号 CH3COOH + OH- 加CH3COO- 的话浓度上升,平衡右移;加H2O的话浓度下降,又是右移.是不是说盐类水解,弱根离子浓度越大或越小都会促进反应,那就乱套了.
来源:学生作业帮助网 编辑:作业帮 时间:2024/11/20 00:45:37
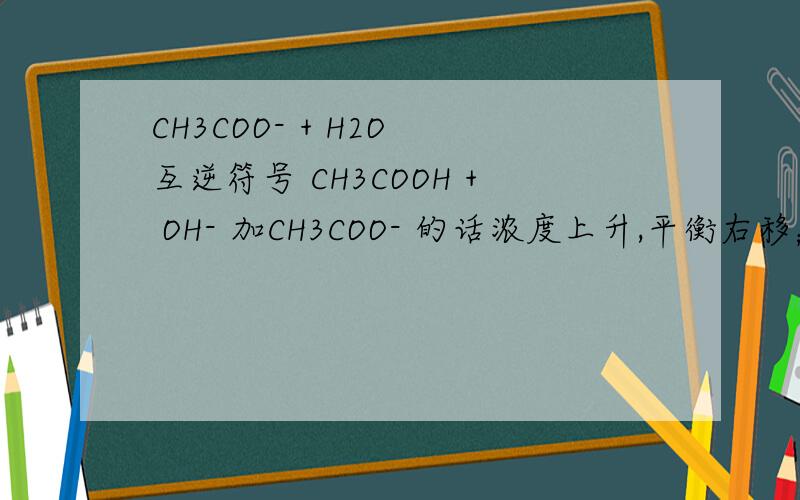
CH3COO- + H2O 互逆符号 CH3COOH + OH- 加CH3COO- 的话浓度上升,平衡右移;加H2O的话浓度下降,又是右移.是不是说盐类水解,弱根离子浓度越大或越小都会促进反应,那就乱套了.
CH3COO- + H2O 互逆符号 CH3COOH + OH- 加CH3COO- 的话浓度上升,平衡右移;加H2O的话浓度下降,又是右移.是不是说盐类水解,弱根离子浓度越大或越小都会促进反应,那就乱套了.
CH3COO- + H2O 互逆符号 CH3COOH + OH- 加CH3COO- 的话浓度上升,平衡右移;加H2O的话浓度下降,又是右移.是不是说盐类水解,弱根离子浓度越大或越小都会促进反应,那就乱套了.
没有问题:
增大CH3COO- 的浓度,平衡右移,但水解程度减小
加H2O的话,CH3COO- 浓度下降,但生成物(CH3COOH \ OH- )浓度也减少,总减少的倍数比反应物多,因此平衡平衡右移,且水解程度增大
盐类水解,浓度越小,水解程度越大,所以加水稀释后,促进醋酸根水解,反应正向移动 这个没错
加了醋酸根,醋酸根浓度增大,按照平衡移动原理,反应物浓度增大,反应方向朝着减小反应物浓度的方向进行,所以反应正向移动也没错,但醋酸根的水解程度减小了,不知这么说楼主明白否?...
全部展开
盐类水解,浓度越小,水解程度越大,所以加水稀释后,促进醋酸根水解,反应正向移动 这个没错
加了醋酸根,醋酸根浓度增大,按照平衡移动原理,反应物浓度增大,反应方向朝着减小反应物浓度的方向进行,所以反应正向移动也没错,但醋酸根的水解程度减小了,不知这么说楼主明白否?
收起
楼主,并不是说盐类水解,弱根离子浓度越大或越小都会促进反应。或者说,你对上面的“加CH3COO- 的话浓度上升,平衡右移;加H2O的话浓度下降,又是右移”的理解不应该是这样的。
加了醋酸根,醋酸根浓度增大,按照平衡移动原理,反应物浓度增大,反应方向朝着减小反应物浓度的方向进行,即反应正向移动没错。加水后,不止CH3COO-浓度减少,所有物质的浓度都下降了,除了H2O本身。然而,H2O作为反...
全部展开
楼主,并不是说盐类水解,弱根离子浓度越大或越小都会促进反应。或者说,你对上面的“加CH3COO- 的话浓度上升,平衡右移;加H2O的话浓度下降,又是右移”的理解不应该是这样的。
加了醋酸根,醋酸根浓度增大,按照平衡移动原理,反应物浓度增大,反应方向朝着减小反应物浓度的方向进行,即反应正向移动没错。加水后,不止CH3COO-浓度减少,所有物质的浓度都下降了,除了H2O本身。然而,H2O作为反应物之一,在体系中比例增大(你也可以理解为H2O浓度增大)按照平衡移动原理,反应肯定是正向移动的。这就是为什么盐类水解,浓度越小,水解程度越大了。
我这样说,楼主明白吗?
收起